
微信扫一扫
关注公众号
甲流来袭,加快甲流研究和药物开发的神器了解一下(内附干货文献)
发布时间:2025-02-06 10:08 | 点击次数:430
前言
最近甲型流感盛行,根据疾控中心统计,目前流感病毒阳性率持续上升,这波流感99%以上都是甲流。许多感染者出现高烧、全身酸痛、咳嗽和流鼻涕的症状。作者本人也不幸中招,深受其扰。目前能够治疗甲流的药较少,加快流感病毒疫苗和抗病毒药物的研发尤为重要。
在疫苗研发方面,一种新型减毒活流感疫苗在临床试验中显示出可诱导血清和黏膜抗体,这些抗体能够交叉中和不同的流感病毒株。在疫苗开发中,病毒滴度实验和抗体中和实验通常是对单层宿主细胞用结晶紫或H&E染色,然后形成的病毒蚀斑进行手工计数,这个过程既耗时又存在主观误差。为了提高产量、精度和灵敏度,可以使用96孔板培养宿主细胞并用荧光蛋白或抗体标记病毒颗粒进行荧光灶斑分析。不过,由于使用荧光显微镜只能分析孔内的一小部分区域,导致荧光灶斑计数可能不准确。因此,采用高通量且基于整孔的病毒滴度和抗体中和测定方法,对于减毒活疫苗的开发和生产具有明显优势。

高速:3.5-10分钟,检测整板
全面:全孔成像,无一遗漏
准确:统一标准,电子存档
在本文的工作中,研究人员利用Celigo高通量细胞成像分析仪展示了一种用于甲型流感病毒荧光灶斑计数的高效方法,并将其与传统荧光显微镜方法的数据进行了对比,结果显示出高度一致性。Celigo的自动化成像与分析技术显著提升了甲型流感病毒滴度测定和抗体中和实验的速度与通量,从而有助于提高甲型流感疫苗及抗病毒药物开发和生产的准确性和效率。
01 病毒滴度和抗体中和实验方案

02 病毒滴度实验-荧光成像和灶斑计数


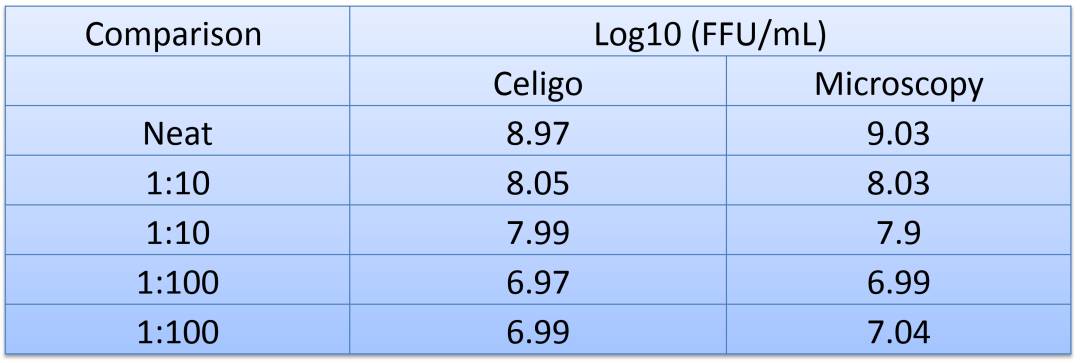
Celigo能够在不同的病毒滴度下进行Dylight-488阳性灶斑计数;
Celigo整板全孔明场+荧光成像和分析<10min;
Celigo对荧光灶斑的计数结果与荧光显微镜方法的计数结果高度一致。
03抗体中和实验–荧光成像和灶斑计数
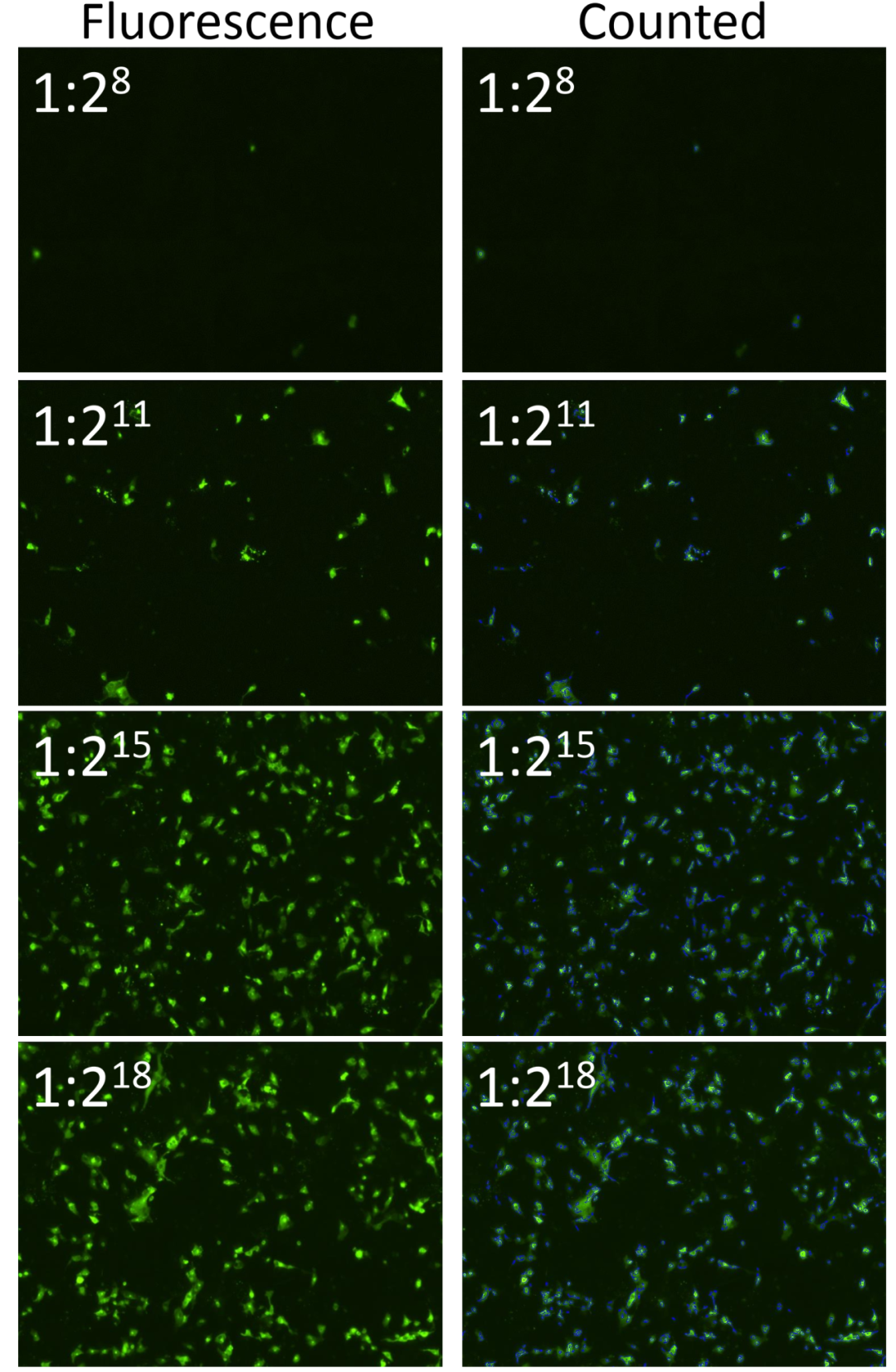
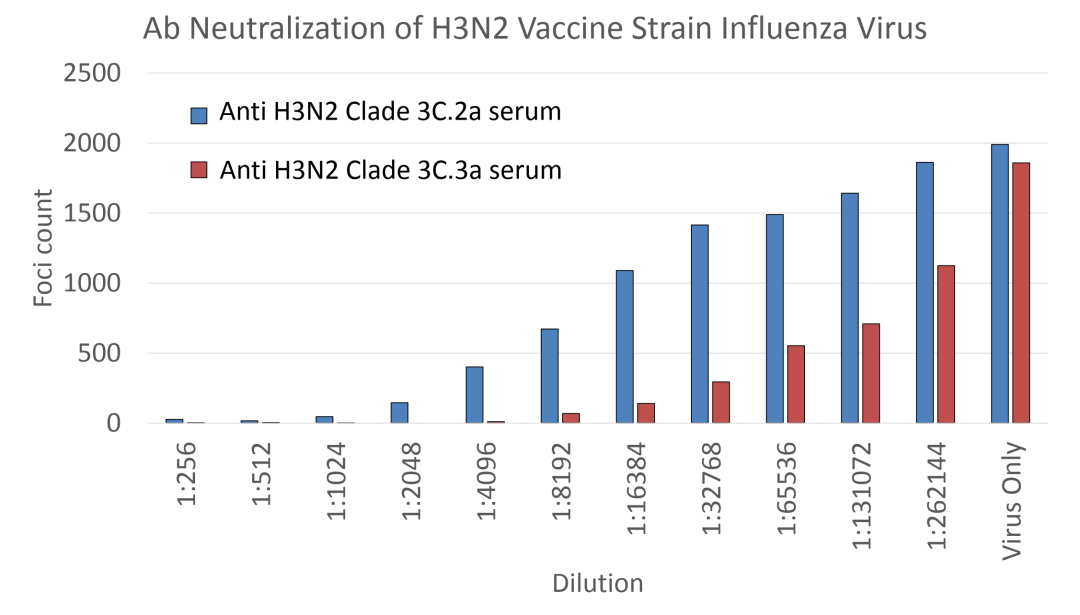
Celigo分析抗H3N2 Clade 3C.2a血清和抗H3N2 Clade 3C.3a血清的抗体中和实验。这两份血清用于中和14种甲流病毒株,结果显示,这两种血清对14种甲流病毒株表现出不同程度的中和效果。
总结
Celigo可进行全孔高通量成像,96孔板整板全孔明场/荧光成像及灶斑分析<10min;
传统的病毒学测定和手动计数通常基于6/12/24孔板,Celigo方法可以缩小规模至96孔或384孔板,从而实验节省材料,并能够在较短的孵育时间后自动成像和分析;
Celigo成像分析的方法能够提高疫苗和抗病毒药物开发与生产的准确性和效率,有助于建立病毒学检测的判定标准。
Celigo高通量细胞成像分析仪可进行的病毒学检测
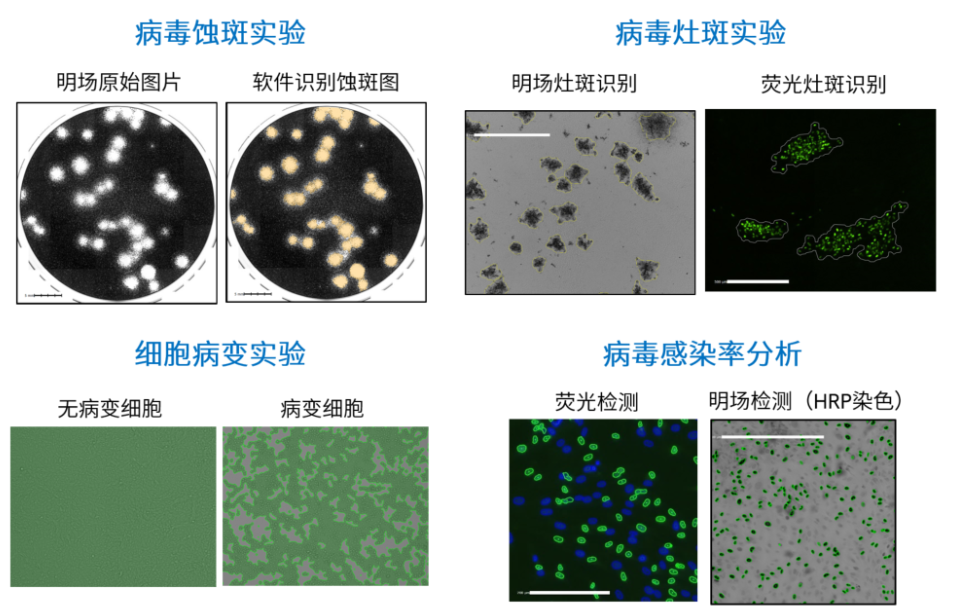
干货文献区
Celigo在流感病毒疫苗开发方面应用文献:
1.Boyoglu-Barnum S, Ellis D, Gillespie R A, et al. Quadrivalent influenza nanoparticle vaccines induce broad protection[J]. Nature, 2021, 592(7855): 623-628.
2.Andrews S F, Raab J E, Gorman J, et al. A single residue in influenza virus H2 hemagglutinin enhances the breadth of the B cell response elicited by H2 vaccination[J]. Nature Medicine, 2022, 28(2): 373-382.
3.Einav T, Creanga A, Andrews S F, et al. Harnessing low dimensionality to visualize the antibody–virus landscape for influenza[J]. Nature Computational Science, 2023, 3(2): 164-173.
4.Myers M L, Gallagher J R, Woolfork D M D, et al. Impact of adjuvant: Trivalent vaccine with quadrivalent-like protection against heterologous Yamagata-lineage influenza B virus[J]. Frontiers in Immunology, 2022: 5750.
5.Behzadi M A, Stein K R, Bermúdez-González M C, et al. An Influenza Virus Hemagglutinin-Based Vaccine Platform Enables the Generation of Epitope Specific Human Cytomegalovirus Antibodies[J]. Vaccines, 2019, 7(2): 51.
Celigo在抗流感病毒抗体开发方面应用文献:
1.Creanga A, Gillespie R A, Fisher B E, et al. A comprehensive influenza reporter virus panel for high-throughput deep profiling of neutralizing antibodies[J]. Nature Communications, 2021, 12(1): 1722.
2.Kirkpatrick E, Henry C, McMahon M, et al. Characterization of novel cross-reactive influenza B virus hemagglutinin head specific antibodies that lack hemagglutination inhibition activity[J]. Journal of Virology, 2020, 94(23): e01185-20.
3.Kirkpatrick Roubidoux E, Sano K, McMahon M, et al. Novel epitopes of the influenza virus n1 neuraminidase targeted by human monoclonal antibodies[J]. Journal of Virology, 2022, 96(9): e00332-22.
4.Chuang G Y, Shen C H, Cheung C S F, et al. Sequence-Signature Optimization Enables Improved Identification of Human HV6-1-Derived Class Antibodies That Neutralize Diverse Influenza A Viruses[J]. Frontiers in Immunology, 2021, 12: 662909.
Celigo在抗流感病毒药效评估方面应用文献:
1.Te Velthuis A J W, Zubkova T G, Shaw M, et al. Enisamium reduces influenza virus shedding and improves patient recovery by inhibiting viral RNA polymerase activity[J]. Antimicrobial Agents and Chemotherapy, 2021, 65(4): e02605-20.
2.Patel M C, Chesnokov A, Jones J, et al. Susceptibility of widely diverse influenza a viruses to PB2 polymerase inhibitor pimodivir[J]. Antiviral research, 2021, 188: 105035.
3.O’Hanlon R, Leyva-Grado V H, Sourisseau M, et al. An influenza virus entry inhibitor targets class II PI3 kinase and synergizes with oseltamivir[J]. ACS infectious diseases, 2019, 5(10): 1779-1793.
4.Yang M L, Wang C T, Yang S J, et al. IL-6 ameliorates acute lung injury in influenza virus infection[J]. Scientific reports, 2017, 7(1): 43829.
Celigo在流感病毒科学研究中的应用:
1.Ellis D, Lederhofer J, Acton O J, et al. Structure-based design of stabilized recombinant influenza neuraminidase tetramers[J]. Nature Communications, 2022, 13(1): 1825.
2.Haney J, Vijayakrishnan S, Streetley J, et al. Coinfection by influenza A virus and respiratory syncytial virus produces hybrid virus particles[J]. Nature Microbiology, 2022: 1-12.
3.Si L, Bai H, Rodas M, et al. A human-airway-on-a-chip for the rapid identification of candidate antiviral therapeutics and prophylactics[J]. Nature Biomedical Engineering, 2021, 5(8): 815-829.
4.Sims A, Tornaletti L B, Jasim S, et al. Superinfection exclusion creates spatially distinct influenza virus populations[J]. Plos Biology, 2023, 21(2): e3001941.
5.Charman M, McFarlane S, Wojtus J K, et al. Constitutive TRIM22 expression in the respiratory tract confers a pre-existing defence against influenza A virus infection[J]. Frontiers in Cellular and Infection Microbiology, 2021, 11: 689707.
6.Ramos I, Smith G, Ruf-Zamojski F, et al. Innate immune response to influenza virus at single-cell resolution in human epithelial cells revealed paracrine induction of interferon lambda 1[J]. Journal of virology, 2019, 93(20): e00559-19.

